Se trata de la variación de la masa con la velocidad.
CONTRACCIÓN RELATIVISTA
La contracción de Lorentz es un efecto relativista que consiste en la contracción del tamaño de un cuerpo a medida que su velocidad se acerca a velocidades comparables con la velocidad de la luz. Originalmente fue un concepto introducido por Lorentz como una forma de explicar la ausencia de resultados positivos en el experimento de Michelson y Morley. Posteriormente fue deducido por Albert Einstein en el contexto de la relatividad especial.
La contracción de Lorentz viene descrita por la siguiente expresión

donde L0 es la distancia medida por un observador estacionario y L1 es la distancia medida por un observador que se desplaza a una velocidad v siendo c la velocidad de la luz.
La contracción de Lorentz también puede entenderse como el efecto de dilatación del tiempo y como el aumento de la masa inercial de un cuerpo o partícula.
DILATACION DEL TIEMPO
La dilatación del tiempo es el fenómeno predicho por la teoría de la relatividad, por el cual un observador observa que el reloj de otro (un reloj físicamente idéntico al suyo) está marcando el tiempo a un ritmo menor que el que mide su reloj. Esto se suele interpretar normalmente como que el tiempo se ha ralentizado para el otro reloj, pero eso es cierto solamente en el contexto del sistema de referencia del observador. Localmente, el tiempo siempre está pasando al mismo ritmo. El fenómeno de la dilatación del tiempo se aplica para cualquier proceso que manifieste cambios a través del tiempo.
POSTULADOS DE EISTEIN
1.- Las leyes de la Física son válidas y tienen la misma expresión matemática en todos los sistemas de referencia inerciales.
2. La velocidad de la luz es la misma para todos los sistemas inerciales. En otras palabras, la velocidad de la luz es la misma cualesquiera que sean el movimiento del foco y del observador.
CONSECUENCIAS DE LA TEORIA DE LA RELATIVIDAD
1. Las leyes del movimiento de Newton son una aproximación de otras leyes reales más generales.
2. La noción de espacio, tomada aisladamente, carece de sentido, pues sólo tiene realidad el conjunto espacio-tiempo.
3. Ninguna velocidad puede exceder la velocidad de la luz.
4. 4. La energía está dotada de una especie de inercia y es equivalente a la materia
5. Las dimensiones de los cuerpos varían con la velocidad de que estén animados. Así, una esfera se transforma en un elipsoide aplastado en el sentido del movimiento. Cuando la velocidad del cuerpo alcanza la de la luz, desaparece la tercera dimensión hasta el punto de aparecer el cuerpo sin espesor.
6. La masa de un cuerpo en movimiento aumenta con la velocidad, hasta hacerse infinita si el cuerpo llega a alcanzar la velocidad de la luz.
7. No existe tiempo general .y absoluto, sino tiempo local propio de cada sistema de referencia.
POSTULADO DE PLANCK
La constante de Planck, simbolizada con la letra h (o bien ħ=h/2π, en cuyo caso se conoce como constante reducida de Planck), es una constante física que representa al cuanto elemental de acción. Es la relación entre la cantidad de energía y de frecuencia asociadas a un cuanto o a una partícula. Desempeña un papel central en la teoría de la mecánica cuántica y recibe su nombre de su descubridor, Max Planck, uno de los padres de dicha teoría.
La constante de Planck relaciona la energía E de los fotones con la frecuencia ν de la onda lumínica (letra griega nu) según la fórmula:
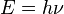
FUNCION DE TRABAJO
La función de trabajo, es la energía mínima (normalmente medida en electronvoltios), necesaria para arrancar un electrón de un sólido, a un punto inmediatamente fuera de la superficie del sólido (o la energía necesaria para mover un electrón desde el nivel de energía de Fermi hasta el vacío). Aquí "inmediatamente" significa que la posición final del electrón está lejos de la superficie a escala atómica pero todavía cerca del sólido en una escala macroscópica. La función de trabajo es una propiedad fundamental para cualquier sustancia sólida con una banda de conducíón (tanto vacía como parcialmente llena). Para un metal, el nivel de Fermi está dentro de la banda de conducción, indicando que la banda esta parcialmente llena. Para un aislante, el nivel de Fermi cae dentro del gap, indicando una banda de conducción vacía; en este caso, la energía mínima para arrancar un electron es aproximadamente la suma de la mitad del gap, y la función de trabajo.
EFECTO FOTOELÉCTRICO
El efecto fotoeléctrico consiste en la emisión de electrones por un material cuando se le ilumina con radiación electromagnética (luz visible o ultravioleta, en general). A veces se incluyen en el término otros tipos de interacción entre la luz y la materia:
* Fotoconductividad: es el aumento de la conductividad eléctrica de la materia o en diodos provocada por la luz. Descubierta por Willoughby Smith en el selenio hacia la mitad del siglo XIX.
* Efecto fotovoltaico: transformación parcial de la energía luminosa en energía eléctrica. La primera célula solar fue fabricada por Charles Fritts en 1884. Estaba formada por selenio recubierto de una fina capa de oro.
El efecto fotoeléctrico fue descubierto y descrito por Heinrich Hertz en 1887. La explicación teórica solo fue hecha por Albert Einstein en 1905 quien basó su formulación de la fotoelectricidad en una extensión del trabajo sobre los cuantos de Max Planck. Más tarde Robert Andrews Millikan pasó diez años experimentando para demostrar que la teoría de Einstein no era correcta... y demostró que sí lo era. Eso permitió que Einstein y Millikan compartiesen el premio Nobel en 1921 y 1923 respectivamente.

Diagrama del efecto fotoeléctrico. Los fotones incidentes son absorbidos por los electrones del medio dotándoles de energía suficiente para escapar de éste.
ESPECTRÓMETRO
El Espectrómetro es un aparato capaz de analizar el espectro característico de un movimiento ondulatorio. Se aplica a variados instrumentos que operan sobre un amplio campo de longitudes de onda.
ESPECTRO DE LINEAS DE EMISIÓN Y DE ABSORCIÓN
Cada átomo es capaz de emitir o absorber radiación electromagnética, aunque solamente en algunas frecuencias que son características propias de cada uno de los diferentes elementos químicos.
Si, mediante suministro de energía calorífica, se estimula un determinado elemento en su fase gaseosa, sus átomos emiten radiación en ciertas frecuencias del visible, que constituyen su espectro de emisión.
Si el mismo elemento, también en estado de gas, recibe radiación electromagnética, absorbe en ciertas frecuencias del visible, precisamente las mismas en las que emite cuando se estimula mediante calor. Este será su espectro de absorción.
Se cumple, así, la llamada Ley de Kirchoff, que nos indica que todo elemento absorbe radiación en las mismas longitudes de onda en las que la emite. Los espectros de absorción y de emisión resultan ser, pues, el negativo uno del otro.
SERIE ESPECTRAL
La serie espectral se explica con el modelo del campo cristalino que esta relacionado con los colores que se observa en distintos complejos, y esto es así ya que la diferencia de energía entre orbitales es del mismo orden de magnitud que la energía de un fotón de luz visible, la cual excita a un electrón de los orbitales de menor energía hacia los de mayor energía. La magnitud de la diferencia de energía y en consecuencia, el color de un complejo, depende tanto del metal como de los ligandos que lo rodean.
ÁTOMO DE BOHR
El modelo atómico de Bohr o de Bohr-Rutherford es un modelo cuantizado del átomo que Bohr propuso en 1913 para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo. Este modelo planetario es un modelo funcional que no representa el átomo (objeto físico) en sí sino que explica su funcionamiento por medio de ecuaciones.
Niels Bohr se basó en el átomo de hidrógeno para realizar el modelo que lleva su nombre. Bohr intentaba realizar un modelo atómico capaz de explicar la estabilidad de la materia y los espectros de emisión y absorción discretos que se observan en los gases. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. El modelo atómico de Bohr partía conceptualmente del modelo atómico de Rutherford y de las incipientes ideas sobre cuantización que habían surgido unos años antes con las investigaciones de Max Planck y Albert Einstein. Debido a su simplicidad el modelo de Bohr es todavía utilizado frecuentemente como una simplificación de la estructura de la materia.

Diagrama del modelo atómico de Bohr.
NUMERO CUÁNTICO PRINCIPAL
Los números cuánticos describen los valores de las variables dinámicas que se conservan en los sistemas cuánticos. Corresponden por tanto con aquellos observables que conmutan con el Hamiltoniano del sistema. Así, los números cuánticos permiten caracterizar los estados estacionarios, es decir los estados propios del Hamiltoniano.
En física atómica, los números cuánticos son valores numéricos discretos que nos indican las características de los electrones de los átomos, esto está basado en la teoría atómica de Niels Bohr que es el modelo atómico más aceptado y utilizado en los últimos tiempos por su simplicidad.
En física de partículas también se emplea el término números cuánticos para designar a los posibles valores de ciertos observables o magnitud física que poseen un espectro o rango posible de valores discreto.
NIVEL DE ENERGÍA
Los niveles de energía son los electrones que están girando alrededor del núcleo formando capas. En cada una de ellas, la energía que posee el electrón es distinta. En efecto; en las capas muy próximas al núcleo, la fuerza de atracción entre éste y los electrones es muy fuerte, por lo que estarán fuertemente ligados.
El hecho pues, de que los electrones de un átomo tengan diferentes niveles de energía, nos lleva a clasificarlos por el nivel energético (o banda energética) en el que se encuentra cada uno de ellos. Las bandas que nos interesa a nosotros para entender mejor el comportamiento del átomo son:
- La Banda de Valencia: Es un nivel de energía en el que se realizan las combinaciones químicas. Los electrones situados en ella, pueden transferirse de un átomo a otro, formando iones que se atraerán debido a su diferente carga, o serán compartidos por varios átomos, formando moléculas.
- La Banda de conducción: es un nivel de energía en el cual los electrones están aún más desligados del núcleo, de tal forma que, en cierto modo, todos los electrones (pertenecientes a esa banda) están compartidos por todos los átomos del sólido, y pueden desplazarse por este formando una nube electrónica.